다발성 경화증(multiple sclerosis)에 대한 모든 것
- Health
- 2020. 11. 11. 09:57
다발성 경화증에서는 신경 섬유의 보호막 (미엘린)이 손상되어 결국 파괴 될 수 있습니다. 신경 손상이 발생하는 위치에 따라 다발성경화증은 시력, 감각, 조정, 운동, 방광 및 장 조절에 영향을 미칠 수 있습니다.
다발성 경화증 (MS)은 잠재적으로 뇌와 척수 (중추 신경계)의 장애를 일으키는 질환입니다.

다발성 경화증은 신경 섬유 커버와 두뇌 혹은 신체의 나머지 부분 사이의 통신 문제가 발생하는 면역 체계의 공격으로 나타납니다. 결국 이 질병은 신경의 영구적인 손상이나 악화를 일으킬 수 있습니다.
다발성 경화증의 징후와 증상은 매우 다양하며 신경 손상의 양과 영향을 받는 신경에 따라 다릅니다. 중증 MS 가 있는 일부 사람들은 독립적으로 또는 전혀 걸을 수 있는 능력을 잃을 수 있으며, 다른 사람들은 새로운 증상없이 장기간의 평탄한 생활을 경험할 수도 있습니다.
다발성 경화증에 대한 치료법은 아직 없습니다. 그러나 치료는 공격으로부터 회복 속도를 높이고 질병의 진행 과정을 늦추게 하며 증상을 관리하는 데 도움이 될 수 있습니다.
다발성 경화증의 징후와 증상은 영향을 받는 신경 섬유의 위치에 따라 사람마다 그리고 질병의 진행 과정에서 크게 다를 수 있습니다. 증상은 종종 다음과 같은 움직임에 영향을 미칩니다.
l 일반적으로 한 번에 신체 한쪽 또는 다리와 몸통에서 발생하는 하나 이상의 사지의 무감각 또는 쇠약
l 특정 목 움직임, 특히 목을 앞으로 구부릴 때 발생하는 전기 충격 감각 (Lhermitte 징후)
l 떨림, 협응 부족 또는 불안정한 걸음 걸이
다음과 같은 시력 문제도 흔합니다.
l 일반적으로 한 번에 한쪽 눈에서 부분적 또는 완전한 시력 상실, 종종 안구 운동 중 통증 발생
l 장기간의 복시
l 흐릿한 시야
다발성 경화증 증상에는 다음이 포함될 수도 있습니다.
l 분명하지 않은 말투
l 피로
l 현기증
l 신체 부위의 저림 또는 통증
l 성기능, 장 및 방광 기능 문제
대부분의 다발성 경화증 환자는 재발과 완화가 지속되는 질환 과정을 가지고 있습니다. 며칠 또는 몇 주에 걸쳐 발생하고 일반적으로 부분적으로 또는 완전히 개선되는 새로운 증상 또는 재발을 경험합니다. 이러한 재발 후에는 수개월 또는 수년 동안 지속될 수 있는 조용한 질병 완화 기간이 이어집니다.
체온의 작은 상승은 일시적으로 다발성 경화증의 징후와 증상을 악화시킬 수 있지만 이것이 진정한 질병 재발로 간주되지는 않습니다.
재발 완화 다발성 경화증 환자의 최소 50 %는 질병 발병 후 10 ~ 20 년 이내에 완화 기간이 있건 없건 간에 증상이 꾸준히 진행됩니다. 이것은 2 차 진행 다발성경화증(MS)라고 합니다.
증상의 악화에는 일반적으로 이동성 및 보행 문제가 포함됩니다. 질병 진행률은 이차 진행성 다발성 경화증 환자에 따라 크게 다릅니다.
일부 다발성 경화증 환자는 1 차 진행성 다발성 경화증으로 알려진 재발없이 징후와 증상의 점진적 발병과 꾸준한 진행을 경험합니다.
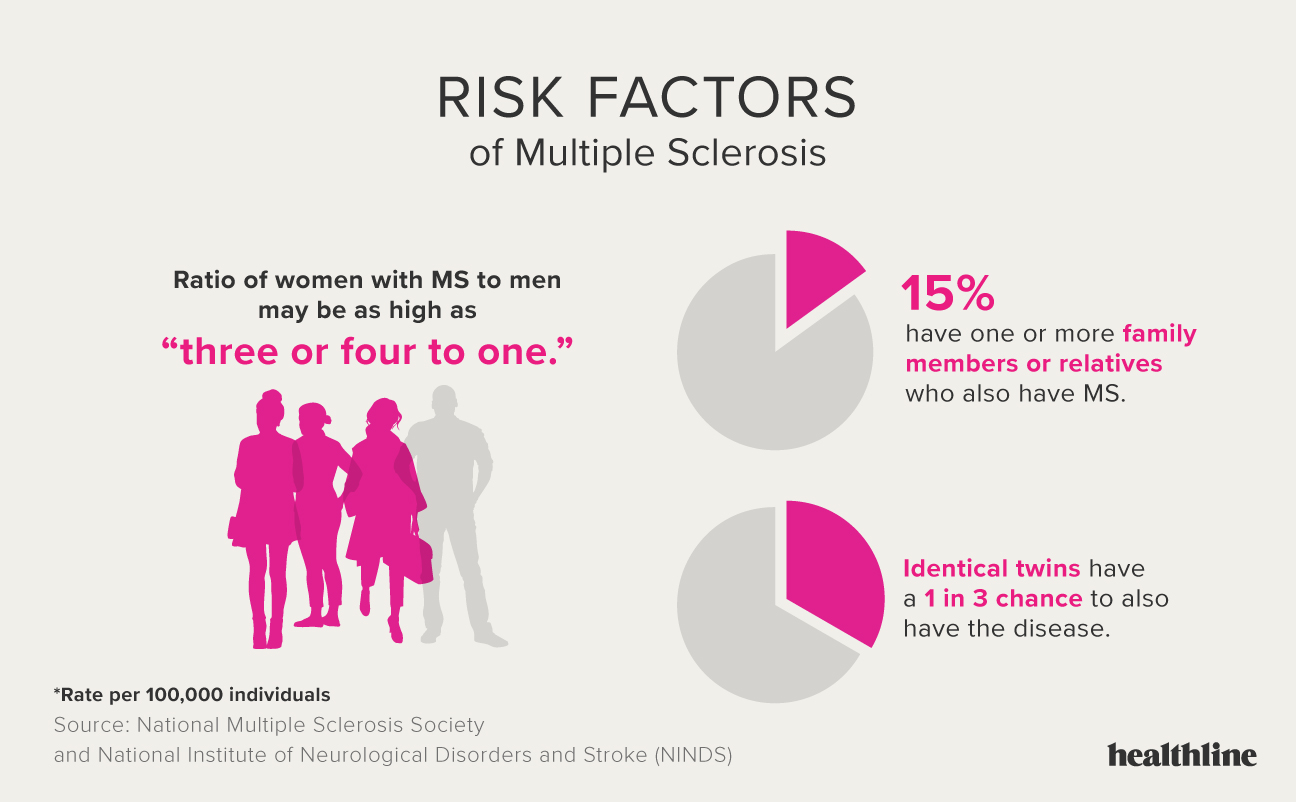
미국에서 250,000 ~ 350,000 만명의 환자가 다발성 경화증을 앓고 있으며, 환자의 5 ~ 50 %는 질병 발병 후 15 년 이내에 걷기가 불편할 수도 있습니다.
남성보다 2 배 많은 여성이 영향을 받고 있으며 북유럽 출신의 사람들이 다발성 경화증 발병 위험이 가장 높은 것으로 보입니다. 이 질환은 뇌의 자기 공명 영상 (MRI) 및 뇌척수액 (CSF) 검사와 같은 보조 테스트의 임상 적 소견과 근거를 바탕으로 진단됩니다. MS는 일반적으로 20 ~ 45 세의 성인에게 나타납니다. 때로는 어린 시절이나 후기 중년에 나타납니다. 원인은 알려져 있지 않지만 유전 적 감수성과 바이러스, 신진 대사 또는 환경 적 요인과 같은 비유 전적 유발 요인이 결합되어 함께 CNS에 대한 반복적인 면역 공격을 유발하는 자가 면역 질환을 유발하는 것으로 보입니다.
신경 학자들은 환자가 질병의 경과에 따라 4 가지 주요 범주로 분류 될 수 있다는 데 동의합니다.
1. 재발 완화 MS : 가장 흔한 형태로 MS 환자의 약 85 %에 영향을 미칩니다. 증상이 호전되거나 사라질때 증상의 재발 (재발 또는 악화)에 이어 완화 기간이 생기기도 합니다.
2. 이차 진행성 MS : 재발 완화 질환이 있는 일부 환자에서 발생할 수 있습니다. 많은 환자의 경우 질병 조절제로 치료하면 이러한 진행을 지연시키는데 도움이됩니다. 질병 경과는 완화 기간 또는 증상 심각도 (고원)의 평준화 여부에 관계없이 계속 악화됩니다.
3. 일차 진행성 MS : 약 10 %의 MS 환자에게 영향을 미칩니다. 증상은 처음부터 점차 악화되고 있습니다. 재발이나 차도가 없지만 가끔 정체가 있을 수 있습니다. 이 형태의 MS는 일반적으로 질병을 치료하는데 사용되는 약물에 더 내성이 있습니다.
4. 진행성 재발 MS : 희귀한 형태로 환자의 5 % 미만에 영향을 미칩니다. 시작부터 점진적이며, 도중에 증상이 간헐적으로 악화됩니다. 완화 기간이 없는 것이 특징입니다.
MS에 대한 단일 진단 테스트는 없습니다.
진단은;
(1) CNS의 백질 (공간 보급 기준)에 있는 두 가지 이상의 다른 병변 (플라크 또는 흉터)의 증거를 기반으로합니다.
(2) 질병 과정에서 2 개 이상의 다른 에피소드 (시간 보급 기준)
(3) CSF (염증 기준)의 분석에 의해 결정된 CNS의 만성 염증.

이러한 기준 중 하나 이상이 있으면 MS의 일반적인 진단이 가능하며, 이는 질병의 후속 과정에 따라 개선 될 수 있습니다. 다발성 경화증 진단에 관한 국제 패널은 시간 전파 기준이 이전 임상 에피소드 후 최소 3 개월 또는 이전 MRI에서 MRI의 임상 징후로 확인되어야 한다고 제안했습니다. 패널은 또한 후자가 임상 및 준 임상 수준에서 누락 된 경우 염증 기준이 공간 보급 기준을 대체 할 수 있다고 제안했습니다.
다발성 경화증, 의사의 진단을 받으려면 필요한 것들.
1. 뇌, 척수 및 시신경을 포함하는 CNS의 두 개 이상의 개별 영역에서 손상의 증거를 찾습니다.
2. 손상 부위가 최소 1 개월 간격으로 발달했는지 확인합니다.
3. 가능한 다른 모든 진단을 제외합니다.
4. 증상이 24 시간 이상 지속되고 1 개월 이상 분리 된 별개의 증상이 발생하는 것을 관찰합니다.
5. MRI (MS에 대한 가장 민감한 영상 검사)를 수행합니다.
6. 척수 천자 및 올리고 클론 밴드 검사를 수행합니다.
병변 부검 시 단단하고 고무 같은 질감이 있는 여러 개의 개별 분홍색 또는 회색 영역이 백질 내에서 식별됩니다. 병변은 림프구 및 대식세포를 포함한 염증 세포의 침윤과 함께 수초 및 희소 돌기 세포 손실 영역으로 구성됩니다. 이러한 병변 내에서 축삭과 뉴런의 상대적 보존은 국소 염증을 동반하는 다른 파괴적인 병리학 적 과정과 MS를 구별하는데 도움이 됩니다.
다발성 경화증 환자의 30 % 이상이 대부분 다리에 중등도에서 중증의 경련을 보입니다. 다발성 경화증 환자의 초기 임상 소견은 감각 장애 (무감각 및 저림), 감각 장애 (화상 및 “핀과 바늘”), 복시, 운동 실조, 현기증 및 방광 (요도 괄약근) 장애입니다. 다발성 경화증의 일반적인 증상은 한쪽 다리에 영향을 미치는 일방적인 무감각으로 다른쪽 다리를 포함하고 골반, 복부 또는 흉부까지 올라갑니다. 감각 장애는 일반적으로 해결되지만 때때로 만성 신경 병성 통증으로 발전합니다. 삼차 신경통도 발생합니다. 다발성 경화증의 또 다른 일반적인 징후는 시력의 완전 또는 부분 상실로 강조되는 시신경염입니다.
방광 기능 장애는 다발성 경화증 환자의 90 % 이상에서 발생하며 환자의 1/3에서 매주 또는 더 빈번한 요실금 현상이 발생합니다. 환자의 30 % 이상이 변비를 경험합니다. 피로는 환자의 90 %에서 발생하며 MS와 관련된 가장 흔한 업무 관련 장애입니다. 성적인 문제도 종종 경험합니다.

질병 관리 요법
다발성 경화증 환자에서 질병 조절제를 사용한 치료의 목표는 급성 악화 기간을 단축하고, 빈도를 줄이고, 증상 완화를 제공하는 것입니다. MS에 대한 치료적, FDA 승인 요법으로 현재 이용 가능한 것은 없습니다.
증상 치료는 기능 유지와 삶의 질 향상을 목표로 합니다. 빠른 작용 효과를 가지고 있고 정맥 내 (IV) 메틸 프레드니솔론과 같은 약물 부작용 (AE)을 거의 생성하지 않는 코르티코 스테로이드의 짧은 과정 (일반적으로 3 ~ 5 일)으로 MS의 급성 재발을 치료하는 것이 일반적입니다. 또는 덱사메타손. 코르티코 스테로이드의 간단한 코스 (예 : 경구 프레드니손 60-100mg, 1 일 1 회, 2 ~ 3 주에 걸쳐 가늘어 짐, 또는 IV 메틸 프레드니솔론 500-1,000mg 3 ~ 5 일 동안 1 일 1 회) 급성 악화를 치료하고 MS 공격의 기간을 단축합니다.
MS에 대한 치료법은 없지만 8 개의 FDA 승인 치료제는 재발이 계속되는 이차 진행성 MS 환자를 포함하여 재발 성 MS의 환자에서 질병 활동과 진행을 줄일 수 있습니다. 아래 표를 참고 해 주세요.
| 의약품 | 브랜드 (제조업체) | 권장 복용량 | 투약 빈도 | 약물투여경로 |
| 인터페론 베타 -1a | Avonex (Biogen Idec) | 30mcg | 매주 1 회 | IM |
| 인터페론 베타 -1a | Rebif (화이자) | 22 또는 44mcg | 주 3 회 | SQ |
| 인터페론 베타 -1b | Betaseron (Bayer) | 0.25 mg | 하루 걸러 | SQ |
| 인터페론 베타 -1b | Extavia (Novartis) | 0.25 mg | 하루 걸러 | SQ |
| Glatiramer 아세테이트 | Copaxone (Teva) | 20mg | 매일 한 번 | SQ |
| 미 톡산 트론 | Novantrone (EMD Serono) | 5 ~ 12mg / m 2 | 3 개월마다 짧은 주입 (약 5 ~ 15 분) | IV |
| 나탈리 주맙 | Tysabri (Biogen Idec) | 300 mg | 4 주마다 1 시간 주입 | IV |
| 핑 골리 모드 | Gilenya (Novartis) | 0.5 mg | 매일 한 번 | PO |
베타 인터페론 (Avonex, Betaseron, Rebif, Extavia)
네 가지 베타 인터페론 약물 –Avonex (Biogen Idec), Rebif (Pfizer), Betaseron (Bayer) 및 Extavia (Novartis) –는 면역 세포에서 분비되는 자연 발생 사이토 카인입니다. 이러한 제제는 다양한 면역 조절 및 항 바이러스 활동을 통해 바이러스 복제를 억제합니다.
MS에서 인터페론 베타-1a와 베타-1b의 작용 기전은 알려져 있지 않지만, 이러한 사이토 카인은 면역계에서 조절 기능을 수행하며 항 염증 특성이 유익하다고 생각됩니다. 베타 인터페론은 약 1/3까지 재발률을 감소시키는 것으로 나타 났으며 글라티라머아세테이트에 과민증이 있는 재발 완화 MS 환자에게 권장됩니다. 무작위, 이중 맹검, 위약 대조 시험에서, MS 환자에게 베타 인터페론을 사용하면 뇌 MRI 스캔에서 볼 수 있듯이 염증성 병변이 50 %에서 80 %까지 감소했습니다. 또한 이러한 약물이 삶의 질과 인지 기능을 향상 시킨다는 증거가 있습니다.
인터페론 베타 제제로 치료받은 환자는 간 기능 이상, 백혈구 감소증, 갑상선 질환 및 우울증의 위험이 있습니다. 간 효소 (알라닌 아미노 전이 효소 [ALT] 및 아스파 테이트 아미노 전이 효소 [AST])와 백혈구 (WBC) 수를 치료 시작 시점과 그 이후 주기적으로 모니터링 해야 합니다.
독감과 유사한 증상 (예 : 발열, 오한, 불쾌감, 근육통 및 피로)은 인터페론 베타-1a 또는 베타-1b를 투여 받은 환자의 약 60 %에서 발생합니다. 베타 인터페론과 관련된 다른 일반적인 AE에는 주사 부위 반응과 기존 경련의 악화가 포함됩니다.
베타 인터페론으로 치료하면 중화 항체가 발생할 수 있지만 이러한 항체의 장기적인 중요성은 알려져 있지 않습니다. 인터페론 알파를 사용한 치료의 부작용으로 말초 신경 병증이 보고되었지만 인터페론 베타는 그렇지 않았습니다. 인터페론 알파 중단 후 신경 병증이 사라졌습니다.

Glatiramer 아세테이트 (코 팍손)
Glatiramer 아세테이트 (Copaxone, Teva)는 1-글루탐산, 1-라이신, 1-알라닌 및 1-티로신 으로 구성된 합성 된 공중 합체 폴리펩티드 혼합물 입니다. 이 약물은 원래 미엘린 염기성 단백질을 모방하고 경쟁하도록 설계되었습니다. 피하 (SQ) 글라 티라 머 아세테이트 (20mg / 일)는 재발 완화 MS 환자의 발작 률을 감소시키는 것으로 나타났습니다.
미국 Glatiramer Acetate 연구는 재발 완화 MS를위한 유일한 질병 수정 요법으로 이 약물을 사용한 15 년의 치료를 평가했습니다. 1991 년 연구가 시작되었을 때 총 223 명의 환자가 글라 티라 머 아세테이트를 1 회 이상 투여 받았습니다. 15 년에 환자의 80 % 이상이 22 년 동안 다발성 경화증을 앓았음에도 불구하고 여전히 도움없이 걷고있었습니다. 연간 재발률은 기준선 1.12에서 연간 0.25로 지속적인 감소를 보였으며 환자의 65 %는 이차 진행성 MS로 진행하지 않았습니다. 모든 글라 티라 머 아세테이트 치료 환자에서 연간 재발률은 1.18에서 0.43으로 감소했으며 이차 진행성 MS는 25 % 만 발생했습니다. 장기적인 안전 문제는 없었습니다.
약물의 작용 기전은 베타 인터페론의 작용 기전과 다릅니다. 따라서 환자는 이 약제에 다르게 반응 할 수 있습니다. 정확한 작용 기전은 알려져 있지 않지만, 동물 연구와 시험관 내 관찰에 따르면 투여시 글라 티라 머 아세테이트 특이 억제 인자 T 세포가 주변에서 유도되고 활성화됩니다. 이 약물은 재발 완화 MS 환자와 베타 인터페론을 견딜 수 없는 환자에게 1 차 치료로 권장됩니다. 재발 완화 MS 환자에 대한 MRI 평가에서 글라 티라 머 아세테이트는 염증 활동을 1/3까지 감소 시켰습니다.
인터페론 베타와 달리 글라 티라 머 아세테이트는 간 기능 이상, 백혈구 감소증 또는 갑상선 질환을 유발하지 않으며 우울증이나 독감 유사 반응과 관련이 없습니다.
글라 티라 머 아세테이트로 치료받은 2,100 명 이상의 MS 환자를 대상으로 한 설문 조사에서 44 %가 이상 반응을 경험했다고 보고했습니다 (4 %가 유의미 함). 28 일반적인 이상 반응은 주사 부위 반응 (35 %), 가려움증 또는 발진 (11 %), 독감 유사 증상 (8 %), 흉통 (4 %), 일과성 열감 (4 %) 및 두통 (4 %)이었습니다. 일시적인 반응에는 홍조와 흉부 압박감 또는 주사 직후 통증이 포함되었습니다.
미 톡산 트론 (Novantrone)
MS에서의 사용 승인 이전에 mitoxantrone (Novantrone, EMD Serono)은 특정 형태의 암 치료에 사용되었습니다. 미 톡산 트론은 수초에 대한 공격을 유도하는 것으로 생각되는 T 세포, B 세포 및 대 식세포의 활동을 억제합니다. 합성 항종 양성 탄저병으로 DNA에 삽입되어 RNA를 방해합니다. 이 약물은 손상된 DNA를 복구하는 효소 인 topoisomerase II의 강력한 억제제입니다. 시험관 내 연구에 따르면 미 톡산 트론은 B 세포, T 세포 및 대 식세포 증식을 억제하고 항원 제시는 물론 인터페론 감마, 종양 괴사 인자 (TNF)-알파 및 인터루킨-2 (IL-2)의 분비를 손상시킵니다. ).
이중 맹검, 무작위 연구에서 (8 밀리그램 / m 미 톡산 트론 수신 재발 완화 성 다발성 경화증 환자 2 월)는 크게 환자 주어진 위약 (비교 일년에 재발률 감소 보였다 P = 0.014). 다른 이중 맹검 연구에서이 차 시브 MS에게 수신 미 톡산 트론 (12 밀리그램 / m 재발 환자 2 3개월 월별)는 12 밀리그램 / m 뒤에 2 32개월까지 3 개월에 한번씩. 이 환자들은 확장 된 장애 상태 척도 (EDSS)에 의해 측정 된 바와 같이 장애 점수에서 상당한 긍정적 개선을 보였습니다.
MS가 악화 된 환자를 대상으로 실시한 5 건의 무작위, 맹검, 대조 시험 및 공개 안전성 연구에서 미 톡산 트론과 관련된 가장 흔한 AE는 메스꺼움 및 구토 (18 % –85 %), 탈모증 (33 % –61 %), 무월경 (8 % –53 %), 요로 감염 (6 % –32 %) 및 상부 호흡기 감염 (4 % –53 %). 30 명의 백혈구 감소증은 환자의 10 ~ 19 %에서 발생했습니다. 미 톡산 트론의 사용은 심각한 AE, 특히 심장 독성을 유발할 수 있습니다. 골수 억제; 드물게 백혈병. 이 임상 연구에서 제한된 심장 독성이 보고 되었습니다.
Mitoxantrone은 재발 완화 MS 또는 이차 진행성 MS를 악화시키는 효과적인 치료법을 제공합니다. 미 톡산 트론을 권장 된대로 사용하면 신중한 환자 선택, 약물 투여 및 모니터링을 통해 상당한 골수 억제 및 심장 독성 영향의 위험을 줄일 수 있습니다. 2 치료 3 년 또는 수명 누적 투여 량은 140 mg의 엄격 / m로 한정한다

나탈리 주맙 (Tysabri)
Natalizumab (Tysabri, Biogen Idec / Elan)은 재조합 인간화 면역 글로불린 (IgG 4 ) 단일 클론 항체입니다. 베타 인터페론 및 글라 티라 머 아세테이트와 마찬가지로 MS 환자의 정확한 작용 메커니즘은 완전히 정의되지 않았습니다. 나탈리 주맙은 백혈구 표면 (호중구 제외)에서 발현되는 알파 4β1 및 알파 4β7 인테그린의 알파 4 서브 유닛에 결합하며, 알파 4 매개 백혈구의 대항 수용체 부착을 억제합니다.
한 달에 한 번 정맥으로 투여되는 나탈리 주맙은 매우 후기 활성화 항원 4 (VLA-4)라고하는 접착 분자를 향합니다. Natalizumab은 다발성 경화증 환자의 발작 률을 현저히 감소시키고 모든 중증도 측정을 크게 개선합니다.
MS 치료에 대한 FDA의 나탈리 주맙 승인은 2,000 명 이상의 환자를 대상으로 한 2 건의 무작위 이중 맹검 위약 대조 시험을 기반으로 했습니다. 두 연구 모두에서 신경 학적 평가는 12 주마다 그리고 재발이 의심되는 시간에 수행되었습니다. MRI는 매년 평가되었습니다.
연구 1에서, 942 명의 환자가 적어도 지난 6 개월 동안 베타 인터페론 또는 글라 티라 머 아세테이트를 받지 않았습니다. 환자들은 최대 28 개월 동안 4 주마다 300mg의 나탈리 주맙 또는 위약을 IV 주입했습니다. 나탈리 주맙을 투여 받은 환자는 0.22의 연간 재발률을 보였고, 위약을 복용 한 환자의 경우 0.67의 재발률을 보였으며, 이는 연구 약물의 상대적 감소를 나타냅니다. 나탈리 주맙 그룹 중 76 %는 위약 그룹의 41 %에 비해 재발이 없는 상태를 유지했습니다.
연구 2에서, 1,171 명의 MS 환자는 연구에 등록하기 전 1 년 동안 근육 내 (IM) 인터페론 베타 -1a (주 1 회 30mcg)를 투여하는 동안 한 번 이상의 재발을 경험했습니다. 그들은 최대 28 개월 동안 4 주마다 300mg의 나탈리 주맙 또는 위약 IV 주입을 받았습니다. 모든 환자는 매주 1 회 인터페론 베타 -1a를 계속 복용했습니다. 나탈리 주맙 치료 환자의 연간 재발률은 0.33으로 위약을 복용 한 환자의 경우 0.75로 나탈리 주맙을 투여 한 환자의 경우 56 % 감소했습니다. 나탈리 주맙 치료 환자 중 54 %는 위약 환자의 46 %에 비해 재발이 없는 상태를 유지했습니다.
나탈리 주맙의 안전성은 중요한 고려 사항입니다. 약물 처방 정보에서 박스형 경고는 일반적으로 사망 또는 중증 장애로 이어지는 뇌의 기회 적 바이러스 감염인 진행성 다 초점 백질 뇌병증 (PML)의 위험이 증가 할 가능성이 있음을 나타냅니다. PML의 위험은 환자가 약물을 더 오래 복용할수록 증가합니다. Natalizumab은 면역 체계가 손상된 환자에게 사용해서는 안됩니다. 치료를 시작하기 전에 MRI 스캔이 필요하며 John Cunningham 바이러스 (JCV) DNA에 대한 CSF 분석이 권장됩니다. 아나필락시스와 심각한 감염도 발생했습니다.
한 보고서는 나탈리 주맙 치료 환자의 CSF에서 JCV 스크리닝을 통해 PML 발병 위험이 높은 환자를 식별 할 수 있으며 이러한 환자에서 치료를 중단하면 임상 질환을 예방할 수 있다고 제안했습니다.
2012 년 1 월 20 일 FDA는 PML의 위험 인자로 항 JCV 항체 상태를 식별하기 위해 나탈리 주맙의 제품 라벨 변경을 승인했습니다. Stratify JCV 테스트의 병렬 승인을 통해 신경과 전문의는 환자의 JC 바이러스 감염 상태를 결정하여 치료 결정을 도울 수 있습니다. 이 분석은 미국에있는 Quest의 Focus Diagnostics 실험실을 통해 제공됩니다.
Fingolimod (Gilenya)
Fingolimod (Gilenya, Novartis)는 재발을 줄이고 MS의 재발 성 형태를 가진 환자의 장애 진행을 지연시키기 위해 FDA에서 승인 한 최초의 경구 투여, 질병 수정 약물입니다. Fingolimod는 sphingosine kinase에 의해 활성 대사 산물 fingolimod phosphate로 대사되는 sphingosine-1-phosphate 수용체 조절제이며, 이는 차례로 림프절에서 림프구의 이동을 차단하여 말초 혈액의 림프구 수를 감소시킵니다. MS에서 fingolimod의 치료 효과의 기초가되는 메커니즘은 알려져 있지 않지만, 림프구가 CNS로 이동하는 감소를 포함 할 수 있습니다.
재발 완화 다발성 경화증 환자를 대상으로 fingolimod에 대한 두 가지 중추적 연구가 수행되었습니다. 12 개월 연구, TRANSFORMS (재발-완화 다발성 경화증에서 FTY720 경구 투여 대비 주사 가능한 인터페론 평가), fingolimod (0.5mg 및 1.25mg)를 인터페론 베타-1a, 및 24 개월 FREEDOMS (FTY720 Research)와 비교했습니다. 다발성 경화증에서 매일 경구 요법의 효과 평가) 시험은 핀 골리 모드 (0.5mg 및 1.25mg)를 위약과 비교했습니다. TRANSFORMS에는 재발 완화 MS를 가진 1,153 명의 평가 가능한 환자가 포함되었습니다. 연간 재발률은 인터페론 그룹 (0.33; P) 과 비교하여 두 fingolimod 치료 그룹 (0.5mg의 경우 0.16, 1.25mg의 경우 0.20)에서 유의하게 낮았습니다. 두 비교 모두 <0.001).
이 연구의 24 개월 연장에서, 연속 핀 골리 모드를 투여받은 환자는 연간 재발률이 지속적으로 개선 된 것으로 나타났습니다. 핀 골리 모드 0.5mg의 경우 재발률은 0-12 개월에 0.12, 13-24 개월에 0.11이었습니다. 핀 골리 모드 1.25 mg을 사용한 해당 재발률은 각각 0.15 및 0.11이었습니다. 인터페론 베타 -1a를 처음 투여 받은 환자의 경우, 이전 12 개월에 비해 핀 골리 모드로 전환 한 후 연간 재발률이 더 낮았습니다. 38 따라서 초기 12 개월 연구와 24 개월 연장 모두에서 1.25-mg 용량의 fingolimod는 0.5mg 용량에 비해 추가적인 이점이 없었습니다.
FREEDOMS에는 재발 완화 MS를 가진 1,033 명의 평가 가능한 환자가 참여했습니다. 연간 재발률은 핀 골리 모드 1.25mg의 경우 0.16, 핀 골리 모드 0.5mg의 경우 0.18, 위약의 경우 0.40이었다 (두 용량 대 위약의 경우 P <0.001). 핀 골리 모드 요법은 위약에 비해 24 개월 치료 기간 동안 장애 진행 위험을 유의하게 감소 시켰습니다 ( P = 0.02). TRANSFORMS에서와 같이, 1.25mg 용량의 핀 골리 모드는 0.5mg 용량에 비해 추가적인 이점을 제공하지 않았습니다.
fingolimod (0.5 또는 1.25 mg)를 투여받은 총 1,703 명의 환자가 재발 완화 MS 환자를 대상으로 한 두 가지 중추적 연구에서 안전 집단을 구성했습니다. fingolimod 0.5mg과 관련된 가장 흔한 AE는 두통, ALT 및 AST 수치 상승, 인플루엔자 바이러스 감염, 설사, 요통 및 기침을 포함했습니다. 혈청 트랜스 아미나 제 상승은 핀 골리 모드 0.5mg을 투여받은 환자의 1 % 이상에서 치료 중단을 초래 한 유일한 AE였습니다. 환자의 3.8 %에서 치료가 중단되었습니다.
환자는 서맥의 징후 및 증상을 모니터링하기 위해 첫 번째 핀 골리 모드 투여 후 6 시간 동안 관찰되어야합니다. Fingolimod는 감염 위험을 증가시킬 수 있으며 시력 증상이 있거나없는 황반 부종이 발생할 수 있습니다. 간 트랜스 아미나 제 수치도 증가 할 수 있습니다.
Fingolimod (1.25 mg)를 투여받은 두 명의 환자가 TRANSFORMS 연구에서 사망했습니다. 파종 된 원발성 수두 대상 포진 감염으로 1 명이 사망했습니다. 다른 사망은 단순 헤르페스 뇌염 때문이었습니다.

증상 치료 방법
달팜 프리 딘 (Ampyra, Acorda)
달팜 프리 딘 (Ampyra, Acorda)은 모든 유형의 다발성 경화증 환자의 보행을 개선하는 것으로 밝혀진 FDA에서 승인 한 최초의 약물입니다. 임상 연구에서 달팜 프리 딘 치료 환자의 약 1/3이 위약 치료 환자에 비해 보행 속도가 더 빠릅니다. 평균 보행 속도는 기준선보다 약 25 % 높았습니다.
Dalfampridine 정제에는 신경 섬유 표면의 칼륨 채널을 차단하는 4-아미노 피리딘의 서방 형 제제가 포함되어 있습니다. 43 이러한 차단 능력은 MS에 의해 절연 수초 코팅이 손상된 신경 섬유에서 신경 신호의 전도를 향상시킬 수 있습니다. 달팜 프리 딘이 도입되기 전에는 MS와 관련된 보행 장애에 대한 약리학 적 치료법이 없었습니다.
최대 권장 복용량은 음식의 유무에 관계없이 매일 두 번 10mg 정제 1 개입니다. 이 복용량을 초과해서는 안됩니다. 정제는 약 12 시간 간격으로 복용해야 하며, 복용량을 놓친 경우 환자는 두 번 또는 추가로 복용해서는 안됩니다.
제품 라벨에 권장 된 것보다 많은 양을 투여하면 dalfampridine이 발작을 일으킬 수 있습니다. 달팜 프리 딘과 관련된 일반적인 AE에는 요로 감염, 불면증, 현기증, 두통, 메스꺼움, 쇠약, 허리 통증, 균형 장애, 코 또는 목의 부기, 변비, 설사, 소화 불량, 목의 통증 및 피부의 작열감, 따끔거림 또는 가려움이 포함됩니다.
오프 라벨 치료 옵션
다음 치료제는 MS의 치료에 대해 FDA의 승인을받지 않았지만 의사는 종종 이러한 목적으로 라벨을 벗어난 상태로 사용합니다.
아자 티오 프린 (Azathioprine)
경구 투여되는 면역 억제제 인 Azathioprine (Imuran, Prometheus)은 2 차 진행성 MS를 치료하기 위해 하루에 2 ~ 3mg / kg의 용량으로 투여됩니다. 여러 소규모 연구의 메타 분석에서 azathioprine은 재발 완화 및 이차 진행성 MS 모두에서 재발률을 감소 시켰습니다.
메토트렉세이트(Methotrexate)
경구 면역 억제제 인 Methotrexate (예 : Rheumatrex, DAVA)는 원래 화학 요법을 위해 단독으로 또는 다른 약제와 함께 개발 (계속 사용)되었습니다. 메토트렉세이트는 다양한 암에 효과적입니다. 또한 심한 건선과 류마티스 관절염 치료에도 사용됩니다. 한 연구에서 메토트렉세이트는 이차 진행성 다발성 경화증 환자에서 상지 기능 장애의 진행을 늦췄습니다. MS에서 메토트렉세이트의 효능과 안전성을 확인하기 위해서는 더 많은 연구가 필요합니다. 메토트렉세이트로 치료받은 환자는 간독성에 대해 모니터링해야 합니다.
사이클로 포스 파 미드(Cyclophosphamide)
세포 독성 알킬화제 인 Cyclophosphamide (예 : Cytoxan, Bristol-Myers Squibb)는 인터페론 베타 -1a를 투여받은 재발 완화 MS 환자의 재발 횟수를 줄이는데 유익한 것으로 밝혀졌습니다. Cyclophosphamide는 DNA에 결합하여 유사 분열 및 세포 복제를 방해합니다.
MS에서 사용하도록 현재 승인 된 질병 조절제는 뇌와 척수에서 생체 이용률이 제한적이거나 전혀 없습니다. 대조적으로, cyclophosphamide는 혈액-뇌 장벽과 CNS 실질을 쉽게 관통합니다. 30 년 이상 임상 시험 및 임상 실습 (오프 라벨 방식)에서 다발성 경화증 환자를 치료하는 데 사용되었습니다. 그러나이 약물에 대한 효능 데이터는 모순되었습니다.
마이코 페놀 레이트 모 페틸 (mycophenolate mofetil)
면역 억제제 mycophenolate mofetil (MMF; CellCept, Genentech)은 활성화 된 림프구에 대해 상대적으로 선택적입니다. 재발 성-완화 및 이차 진행성 다발성 경화증 환자에게 하루에 두 번 500mg 또는 1,000mg의 용량으로 단독으로 또는 인터페론 베타와 함께 경구 투여됩니다. 그러나 MS에서의 효능은 논란의 여지가 있습니다. 7 예비 연구에서 MMF와 인터페론 베타-1a의 조합은 재발 완화 MS를 가진 13 명의 환자에서 내약성이 좋았지 만 12 개월 치료 후 효능 결과는 위약에 비해 통계적으로 유의하지 않았습니다. MMF는 더 큰 표본 크기와 더 긴 추적 기간으로 MS에 대한 추가 조사가 필요합니다.
클라 드리 빈 (Cladribine)
경구용 클라 드리 빈 (Merck KGaA, 독일)은 림프구에 대해 상대적으로 선택적인 아데노신 데 아미나 제 내성 퓨린 뉴 클레오 사이드입니다. 발작 률이나 다발성 경화증의 진행을 바꾸지는 않지만 뇌의 병변을 줄입니다. 7 2010 년 7 월 FDA는 Merck KGaA로부터 클라 드리 빈 정제에 대한 신약 신청서 (NDA)를 승인했습니다. 그러나 2011 년 6 월에는 암 위험으로 인해 다발성 경화증 치료제 개발을 중단했다. 이러한 중단은 fingolimod의 경구 사용을 향상시킬 수 있습니다. Merck / Serono는 FDA의 승인을 추구하지 않기로 결정했습니다. 이 약은 Movectro로 구할 수 있었던 러시아와 호주에서 더 이상 판매되지 않습니다. Leustatin (Janssen)으로 주사 가능한 형태로 사용되는 cladribine은 암 치료에 사용되었습니다.
다발성 경화증에 대한 잠재적 약물
| 약물 이름 | 회사 | 기술 | 치료 용량 |
| 라 퀴니 모드 | Active Biotech / Teva | 합성 소분자, 항염증제 | 0.6 mg 1 일 1 회 PO |
| 테리 플루 노마 이드 | 사노피 / 젠 자임 | 면역 조절제; 레 플루 노 미드의 활성 대사 산물 | 7mg 또는 14mg 1 일 1 회 PO |
| BG-12 (디메틸 푸마 레이트) | 바이오젠 아이 덱 | 면역 조절제 | 240 mg 1 일 2 ~ 3 회 PO |
| 다 클리 주맙 (Zenapax) | Roche | CD25 표적화 인간화 단일 클론 항체 | 1.0 mg / kg IV |
| 알 렘투 주맙 (Campath) | Genzyme | CD52 표적화 인간화 단일 클론 항체 | 12 주 동안 주 3 회 30mg / 일 IV |
| 리툭시 맙 (리툭산) | Genentech | CD20 표적화 키메라 뮤린 / 인간 단일 클론 항체 | 375 mg / m IV |
| 오크 렐리 주맙 | Roche / Biogen Idec | CD20 표적화 인간화 단일 클론 항체 | 600mg 또는 2,000mg 2 회 투여 (1 일 및 15 일) |
라 퀴니 모드(Laquinimod)
Laquinimod (Active Biotech / Teva)는 면역 체계에 영향을 미치는 합성, 경구 활성, 소분자, 항염증제입니다. 라 퀴니 모드는 공격 중심의 Th1 반응 대신 조절 T-도우미 (Th2) 반응을 촉진하기 위해 T 세포 집단을 변경하고, 신경 보호 분자의 합성을 증가시키는 것으로 보입니다.
최근 완료된 3 상 ALLEGRO 시험에서 재발 완화 MS를 가진 총 1,106 명의 환자가 24 개월 동안 laquini-mod (0.6mg) 또는 위약을 투여 받았습니다. 라 퀴니 모드로 치료받은 50 명의 환자는 위약을 투여받은 환자와 비교하여 연간 재발률이 23 %의 통계적으로 유의미한 감소를 경험했습니다 ( P = 0.0024). 이 약물은 또한 장애 진행 위험을 36 % ( P = 0.0122), 뇌 위축을 33 % ( P <0.0001) 감소 시켰습니다 .
24 개월의 3 상 BRAVO 시험 (인터페론 베타-1a의 맹검 기준 팔 [Avonex])에서도 최근에 완료된 라 퀴니 모드 (0.6mg)는 연간 재발률을 21 % 크게 감소 시켰습니다 ( P = 0.026). , 재발 완화 MS 환자에서 위약에 비해 장애 진행 위험이 34 % 감소하고 ( P = 0.044) 뇌 부피 손실이 28 % 감소했습니다 ( P <0.0001).그러나 이러한 결과는 두 치료군 사이의 두 기준 MRI 특성의 차이를 조정 한 후에 달성되었습니다. 이러한 조정없이 라 퀴니 모드는 위약과 비교했을 때 연간 재발률을 줄이는 연구의 1 차 평가 변수를 통계적으로 달성하지 못했습니다 ( P= 0.075). BRAVO 연구 데이터에 대한 추가 분석이 진행 중입니다.
Teriflunomide (Aubagio)
Leflunomide (Arava, Sanofi)의 활성 대사 산물인 Teriflunomide (Aubagio, Sanofi / Genzyme) 는 미토콘드리아 효소 인 dihydro-orotate dehydrogenase (DHODH)를 차단하여 피리 미딘 의 de novo 합성 을 가역적으로 억제하는 면역 조절 약물입니다. DHODH를 억제하고 DNA 합성을 줄임으로써 teriflunomide는 증식하는 B 및 T 세포에 세포 증식 억제 효과를 발휘합니다. Teriflunomide는 1998 년부터 류마티스 관절염 치료에 사용되었습니다.
최근의 3 상 Teriflunomide 다발성 경화증 구강 (TEMSO) 시험에서, 테리 플루 노마 이드 (7mg 또는 14mg)는 MS의 재발 형태를 가진 1,088 명의 환자를 대상으로 위약과 비교되었습니다. 2 년 후, 테리 플루 노마 이드의 두 용량 모두 위약에 비해 연간 재발률을 현저하게 감소 시켰습니다 (각각 37 % 대 54 %, P <0.001). 확인 된 장애 진행은 위약 치료 환자의 27.3 %에서 발생했으며, 테리 플루 노마 이드 (7mg)를 투여받은 환자의 21.7 % ( P = 0.08)와 테리 플루 노마 이드 (14mg)를 투여 한 환자의 20.2 % ( P = 0.03) 에 비해 확인되었습니다.

최근의 또 다른 3 상 연구 인 TENERE 임상 시험에서는 재발 성 MS 환자 324 명을 대상으로 테리 플루 노마 이드 (7mg 및 14mg)를 인터페론 베타-1a (Rebif)와 비교했습니다. 55이 연구에서 teriflunomide는 치료 실패의 위험을 줄이는 데있어 인터페론보다 통계적으로 유의미한 우월성을 보여주지 못했습니다 (연구의 주요 복합 평가 변수). 그러나 Teriflunomide는 인터페론보다 열등하지 않고 수치 적으로 우수했습니다. 더 높은 테리 플루 노마 이드 용량 (14mg)에서 환자의 37.8 %는 인터페론 치료 환자의 42.3 %에 비해 2 년 동안 재발 또는 영구적 인 치료 중단을 확인했습니다. 테리 플루 노마 이드의 수치 적 우월성은 인터페론 군에서 더 높은 탈락률 (21.8 % 인터페론 대 10.9 % 테리 플루 노마 이드 14mg)에 의해 도움이되었을 수 있습니다. TENERE 시험의 장기 연장이 진행 중입니다.
테리 플루 노 마이 드는 다발성 경화증 환자를 대상으로하는 다른 여러 다국적 3 상 연구에서 조사되고 있습니다. 예를 들어, 3 상 임상 시험 인 TOWER는 재발 성 MS 환자 1,110 명을 대상으로 테리 플루 노마 이드 (7mg 및 14mg)를 위약과 비교하고 있습니다. 56 일차 결과 척도는 연간 재발률입니다. 예상 완료 날짜는 2013 년 2 월입니다.
3 상 TERACLES 시험에서, 테리 플루 노 마이 드는 이전에 인터페론 베타로 치료받은 1,455 명의 환자에서 위약과 비교되고 있습니다. 57 이것은 재발 성 다발성 경화증에서 표준 요법에 추가로 경구 약물에 대한 첫 번째 3 상 연구입니다. 재판은 2014 년 4 월에 완료 될 예정입니다. 58
진행중인 또 다른 3 상 시험 인 TOPIC은 MS의 첫 임상 증상을 보인 780 명의 환자를 대상으로 테리 플루 노마 이드 (7mg 또는 14mg)를 위약과 비교하고 있습니다. 59 주된 목적은 teriflunomide가 임상 적으로 확실한 MS 로의 전환을 예방하거나 지연시킬 수 있는지 확인하는 것입니다. 임상 시험의 예상 완료일은 2015 년 11 월입니다. 2011 년 10 월 Sanofi SA와 자회사 Genzyme은 FDA가 MS의 재발 성 MS에 대한 잠재적 인 치료법으로 구강 테리 플루 노 미드에 대한 회사의 NDA 검토를 수락했다고 발표했습니다.
BG-12 (디메틸 푸마 레이트)
BG-12 (Biogen Idec)는 재발 완화 MS에 대한 단일 요법으로 현재 임상 3 상 개발중인 임상 시험용 경구 투여 면역 조절제입니다. 2008 년에 BG-12는 FDA로부터 MS에서 패스트 트랙 지정을 받았습니다.
DEFINE (구강 Fumarate IN rElapsing-reasing MS의 효능 및 안전성 결정)은 MS 환자에서 BG-12를 평가하기위한 첫 번째 3 상 연구였습니다. 이 2 년, 무작위, 이중 맹검, 위약 대조 시험에서, 재발 완화 질환 환자 1,200 명을 대상으로 BG-12 (1 일 2 ~ 3 회 240mg)를 위약과 비교했습니다. 2011 년 4 월에 발표 된 예비 결과에 따르면, 1 일 2 회 및 1 일 3 회 용량 모두 위약에 비해 2 년에 재발 한 재발 완화 MS 환자 비율에서 통계적으로 유의 한 감소 ( P <0.0001)를 제공했습니다.
BG-12는 또한 진행중인 CONFIRM (Relapsing-reasing MS에서 비교기 및 경구 Fumarate) 시험에서 재발 완화 MS 환자에서 평가되고 있습니다. 이 2 년 무작위, 위약 대조, 이중 맹검 연구에서 환자는 경구 BG-12 (240mg 1 일 2 ~ 3 회) 또는 SQ 글라 티라 머 아세테이트 (Copaxone)로 치료를 받고 있습니다.
다 클리 주맙 (Zenapax)
Zenapax 로슈의 FDA 승인 면역이며, IgG의 인간화 된 L을 단일 클론 항체를 특이 적으로 활성화 림프구의 표면 상에 높은 친 화성 IL-2 수용체의 CD25 알파 서브 유닛에 결합한다. 이 약물은 T 세포 고갈을 일으키지 않고 활성화 된 T 세포에서 IL-2 수용체에 선택적으로 결합하고 억제함으로써 효과가 있는 것으로 생각됩니다. 다클리주맙은 신장 이식 후 급성 장기 거부 반응을 예방하기위한 면역 억제 요법의 일부로 승인되었습니다.

2 상 CHOICE 시험에서 SQ daclizumab (2 주마다 2mg / kg)는 인터페론 베타와 병용하여 인터페론 베타 단독에 비해 MS 병변 수가 72 % 감소했습니다. 재발 MS. 64 약력학 하위 분석에서 daclizumab은 면역 체계를 조절하는 데 도움이되는 자연 살해 세포의 CD56 (밝은) 하위 집합의 증가와 관련이 있습니다. 이 증가는 MS 병변 형성의 현저한 감소와 관련이 있습니다.
2b 상 SELECT 시험의 예비 결과는 2011 년 8 월에 발표되었습니다. SELECT는 12 개월 동안 SQ daclizumab (4 주에 한 번 150 또는 300mg)를 재발 완화 MS 환자 600 명의 위약과 비교하도록 설계되었습니다. 다 클리 주맙은 위약에 비해 연간 재발률을 150mg 군에서 54 % ( P <0.0001), 300mg 군에서 50 % ( P = 0.0002) 현저하게 감소 시켰습니다 . Daclizumab은 또한 재발 한 환자의 비율을 55 % (150mg) 및 51 % (300mg) 감소 시켰고 지속적인 장애 진행 위험을 57 % (150mg) 및 43 % (300mg) 감소 시켰습니다. 추가 분석이 진행 중입니다.
재발 완화 MS 환자 12 명의 후 향적 평가에서 daclizumab을 사용한 장기 치료 (24 ~ 60 개월, 평균, 42.1 개월)는 일반적으로 내약성이 우수했습니다. 발진과 림프절 병증은 각각 4 명과 2 명의 환자에서 가장 흔한 이상 반응이었습니다. 림프절 병증 사례 중 하나는 Epstein–Barr 바이러스 감염과 관련이있었습니다.
알 렘투 주맙 (Campath / Lemtrada)
Alemtuzumab (Campath / Lemtrada, Genzyme / Sanofi)는 면역 세포에서 광범위하게 발현되는 세포 표면 분자 인 CD52를 표적으로하는 인간화 단일 클론 항체입니다. 이 약물은 순환에서 림프구 집단을 빠르고 오래 지속시켜 제거하고 신경 보호 효과를 부여 할 수 있습니다. 상표명 Campath로 B 세포 만성 림프 구성 백혈병 (B-CLL)에 대한 단일 요법으로 표시됩니다. 67 Campath는 현재 Lemtrada로 추가 개발 중이며 2012 년 초에 FDA 및 유럽 승인을 위해 제출 될 예정입니다.
2 상 무작위 이중 맹검 연구 (CAMMS223)에서 조기 재발 완화 다발성 경화증 환자 334 명에게 알 렘투 주맙 (12 또는 24mg / 일) 또는 SQ 인터페론 베타 -1a (44mcg 당 3 회)를 주) 36 개월. 69 Alemtuzumab은 베타 인터페론에 비해 연간 재발률을 유의하게 감소 시켰으며 (각각 0.10 대 0.36, P <0.001) 장애의 지속적인 축적 률도 줄였습니다 (각각 9.0 % 대 26.2 %, P <0.001).
병행 실험 연구와 함께 추가 분석은 알 렘투 주맙이 면역 세포 고갈 효과의 결과로 질병 활동을 감소 시켰을뿐만 아니라; 그것은 또한 아마도 자가 반응성 T 세포에서 신경 영양 인자의 생성을 유도함으로써 신경 보호 효과를 부여했다. 그러나 인터페론 베타-1a 그룹과 비교하여 알 렘투 주맙 치료 환자는 갑상선 질환 (각각 23 % 대 3 %) 및 면역 혈소판 감소 성 자반병 (각각 3 % 대 1 %)을 포함하여자가 면역 률이 증가했습니다. 면역 세포 구획의 알 렘투 주맙 매개 왜곡이 면역 기능에 광범위한 영향을 미친다는 것을 보여줍니다. 알 렘투 주맙 환자는 베타 인터페론 그룹보다 감염이 더 많았습니다 (3 % 대 1 %). 69
CAMMS223에는 장기 효능 및 안전성 데이터 수집을 위한 확장 단계가 포함되었습니다. 예비 5 년 데이터는 2011 년 4 월에 보고되었습니다. Alemtuzumab은 인터페론 베타-1a에 비해 5 년차까지 장애가 지속적으로 축적 될 위험을 72 % 감소 시켰습니다 ( P <0.0001). 더욱이 5 년차에는 인터페론 베타-1a를 투여받은 환자의 62 %에 비해 알 렘투 주맙 치료를 받은 환자의 86 %가 장애가 없었습니다. Alemtuzumab은 또한 베타 인터페론에 비해 재발 위험을 65 % 감소 시켰습니다 ( P <0.0001). 인터페론 베타-1a를 투여받은 환자의 41 %에 비해 알 렘투 주맙 치료 환자의 약 72 %가 5 년차에 재발이 없었습니다.
2 상 CAMMS223 연구 후, 알 렘투 주맙은 다발성 경화증 환자를 대상으로 한 2 개의 중추적 인 3 상 시험에서 평가되었습니다. MS에서 Alemtuzumab과 Rebif 효능의 비교, Study One (CARE-MS I)은 MS에 대한 이전 치료를받지 않은 조기 활성 완화-재발 성 MS 환자에서 alemtuzumab과 고용량 인터페론 베타 -1a (Rebif)를 비교했습니다. 스테로이드 제외. 71 CARE-MS II는 승인 된 MS 요법을받는 동안 재발 한 재발 완화 MS 환자에서 알 렘투 주맙과 인터페론 베타 -1a를 비교했습니다.
CARE-MS I에서 알 렘투 주맙 (5 일 동안 12mg / 일 IV, 1 년 후 2 차 3 일 IV 투여)을 인터페론 베타-1a (주당 3 회 44mcg SQ) 받은 환자와 비교했습니다. Alemtuzumab은 2 년 동안 인터페론 베타 -1a에 비해 재발률이 55 % 감소했습니다 ( P <0.0001). 더욱이, 확장 된 장애 상태 척도 (EDSS)에 의해 측정 된 바와 같이, 인터페론 치료 환자 (각각 8 % 대 11 %; P = 0.22).
알 렘투 주맙과 관련된 일반적인 AE에는 주입 관련 반응이 포함되었으며, 이는 일반적으로 심각도가 경증에서 중등도 였습니다. 또한 감염 발생률이 증가했습니다. 가장 흔한 감염은 구강 헤르페스와 함께 상기도 및 요로와 관련되었습니다. 이러한 감염은 주로 경증에서 중등도였으며 생명을 위협하거나 치명적이지는 않았습니다. 심각한 이상 반응의 발생률은 알 렘투 주맙과 인터페론 베타 -1a에서 비슷했습니다 (각각 18.4 % 대 14.4 %). 알 렘투 주맙 치료를받은 환자의 18 %는 자가 면역, 갑상선 관련 이상 반응을 경험했으며 0.8 %는 면역 혈소판 감소증으로 발전했습니다.
CARE-MS II에서는 다른 MS 요법을받은 후 재발을 경험 한 840 명의 환자에게 알 렘투 주맙 (5 일 동안 1 일 1 회 12mg IV, 1 년 후 3 일 동안 1 일 1 회) 또는 인터페론 베타-1a (44mcg 2 년 연구 기간 동안 SQ 주당 3 회). 72 인터페론 베타-1a와 비교하여 알 렘투 주맙의 재발률이 49 % 감소한 것으로 관찰되었습니다 ( P <0.0001). 또한 EDSS ( P = 0.0084)에 의해 측정 된 바와 같이, 알 렘투 주맙 치료 후 지속적인 장애 악화 위험이 42 % 감소했습니다.
알 렘투 주맙과 관련된 가장 흔한 AE는 주입 관련 반응 (두통, 발진, 메스꺼움, 두드러기, 발열, 가려움증, 불면증 및 피로)이었습니다. 두 그룹 모두 알 렘투 주맙 그룹에서 더 높은 발생률 (즉, 상부 호흡기 및 요로 감염, 부비동염 및 단순 포진 감염)이 더 높은 감염을 경험했습니다. 치료 관련 감염은 일반적으로 경증에서 중등도 정도였습니다. 생명을 위협하거나 치명적인 것은 없습니다. 2 년 연구 기간 동안 알 렘투 주맙 환자의 16 %가자가 면역, 갑상선 관련 AE를 경험했으며 1 %는 면역 혈소판 감소증을 경험했습니다.
CARE-MS I 및 CARE-MS II에서보고 된 효능 비율에도 불구하고 안전성 문제 (치명적 혈전 성 혈전 감소 성 자반병)는 알 렘투 주맙을 다발성 경화증에 대한 최종 요법으로 사용할 수 있습니다.
리툭시 맙 (Rituximab)
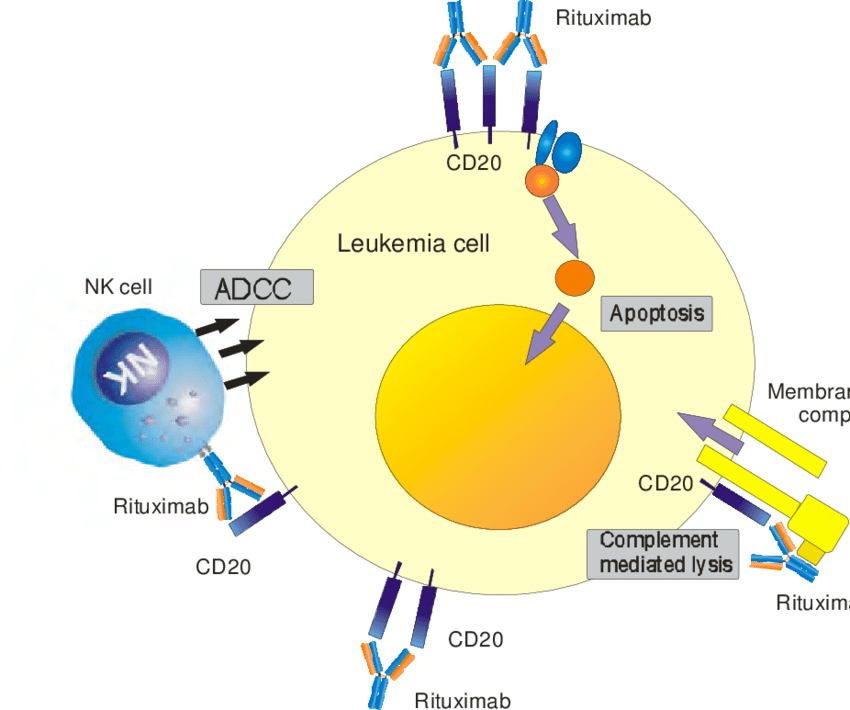
Rituximab (Rituxan, Genentech)는 유 전적으로 조작 된 키메라 뮤린 / 인간 단일 클론 IgG 1 카파 항체로, pre-B 및 성숙 B 림프구에 위치한 소수성 막 관통 단백질 인 CD20 항원에 대해 지시됩니다. CD20은 세포주기 시작 및 분화를위한 활성화 과정의 초기 단계를 조절합니다. rituximab의 Fab 도메인은 B 림프구의 CD20 항원에 결합하고 Fc 도메인은 면역 이펙터 기능을 동원 하여 시험관 내에서 B 세포 용해를 매개 합니다.
공개 라벨 1 상 연구에서 재발 완화 다발성 경화증 환자는 6 개월 간격으로 두 코스의 리툭시 맙을 받았으며 72 주 동안 관찰되었습니다. 경도에서 중등도의 주입 관련 효과가보고되었습니다. 감염은 경증 또는 중등도였으며 치료 중단으로 이어지지 않았습니다. 치료 전 1 년과 비교하여 72 주 추적 기간 동안 명백한 재발 감소가 확인되었습니다.
다발성 경화증 환자에서 리툭시 맙을 사용한 B 세포 고갈의 효과는 이중 맹검 임상 2 상 연구에서 조사되었습니다. 재발 완화 다발성 경화증 환자 104 명을 무작위로 배정하여 리툭시 맙 (1,000mg IV) 또는 위약을 투여 받았으며 48 주 동안 관찰되었습니다. 1 차 효능 평가 변수는 12 주, 16 주, 20 주 및 24 주에 MRI 뇌 스캔에서 발견 된 가돌리늄 강화 (GdE) 병변의 총 수였습니다. 임상 결과에는 재발을 경험 한 환자의 비율이 포함되었습니다. Rituximab 치료 환자는 위약 치료 환자와 비교하여 각 평가 시점에서 GdE 뇌 병변의 수가 현저하게 감소했으며 ( P <0.001), 새로운 GdE 병변의 총 수 ( P<0.001). 더 적은 수의 리툭시 맙 환자가 24 주 (위약을받은 14.5 % 대 34.3 %, P = 0.02)와 48 주 (위약을받은 20.3 % 대 40.0 %, P = 0.04)에 재발을 경험했습니다.
맹검 방사선 학적 종말점을 기반으로 한 소규모 임상 2 상 연구에서 Naismith et al. 리툭시 맙 추가 요법이 MS에 효과적이라는 것을 발견했습니다. 주사 질병 변경 에이전트의 사용에도 불구하고, 18 개월 이전까지 내 경험이 재발했고, 서른 환자는 세 가지 전처리 자기 공명 영상의 획득 리툭시 맵 (375 밀리그램 / m에 적어도 하나 개의 GDE 병변을 가지고 2 사 매주) 복용량. 첫 번째 주입 후 12 주에 시작하여 3 개월의 치료 후 뇌 MRI 스캔을 얻었다. 다발성 경화증 기능성 복합물 (MSFC) 및 EDSS 점수는 기준선과 치료 후 추적 기간 내내 획득되었습니다.
리툭시 맙 치료 후, MRI 스캔의 74 %는 기준선 스캔의 26 %와 비교하여 GdE 활성을 나타내지 않았습니다 ( P <0.0001). 평균 병변 수는 치료 후 한 달에 2.81 개에서 한 달에 0.33 개로 감소하여 88 % 감소했습니다. MSFC 점수는 상당한 개선을 보 였으며 ( P = 0.02) EDSS 점수는 안정적으로 유지되었습니다. 리툭시 맙은 잘 견디며 심각한 AE가보고되지 않았습니다. 이 2 상 연구는 추가 리툭시 맙이 다발성 경화증 환자의 뇌 병변을 감소시키는 것으로 나타났습니다. B 세포 조절 요법은 표준 주사 요법에 대한 부적절한 반응을 보인 재발 성 다발성 경화증 환자에게 여전히 잠재적 인 옵션입니다.
3 상 연구에서 Fleischmann은 류마티스 관절염 및 쇼그렌 증후군 환자에서 리툭시 맙과 관련된 PML 사례를보고했습니다. 이 발견은 약간의 우려를 야기했습니다. PML은 리툭시 맙의 마지막 과정 후 약 18 개월 후에 진단되었고 환자는 1 개월 후에 사망했습니다. 리툭시 맙을 사용한 PML 위험에 대한 더 많은 연구가 필요합니다.
오크 렐리 주맙(Ocrelizumab)
Ocrelizumab (Roche / Biogen Idec)는 성숙한 B 림프구를 표적으로하는 인간화 항 CD20 단일 클론 항체입니다. MS, 류마티스 관절염 및 홍 반성 루푸스와 같은자가 면역 질환에 사용하기 위해 특별히 개발되었습니다. 그러나 2010 년 3 월, Roche는 임상 시험에서 심각한 감염 (일부 치명적)의 발생을 인용하여 류마티스 관절염 및 루푸스 치료 용 ocrelizumab 개발을 중단했습니다. 연구는 MS에서 계속되었습니다.
재발 완화 MS 환자를 대상으로 한 ocrelizumab 2 상 시험 결과가 2011 년에 발표되었습니다. 78 이 무작위 이중 맹검 위약 대조 연구에서 18 세에서 55 세 사이의 성인 218 명에게 저용량의 ocrelizumab을 투여했습니다 ( 600mg) 또는 고용량의 ocrelizumab (2,000mg), 둘 다 2 주 간격으로 2 회 투여하거나 근육 내, 매주 1 회 인터페론 베타-1a (30mcg)와 함께 투여합니다. 24 주차에 GdE-강화 뇌 병변의 수는 위약보다 ocrelizumab 600mg에서 89 % 더 낮았고 ( P <0.0001), ocrelizumab 2,000mg에서 96 % 더 낮았습니다 ( P<0.001). 두 용량 모두 인터페론 베타-1a보다 뇌 병변 수를 줄이는데 더 효과적이었습니다. 연간 재발률은 위약보다 ocrelizumab 600mg에서 80 % 더 낮았고 ocrelizumab 2,000mg에서 73 % 더 낮았습니다.
이부 딜라 스트
샌디에고의 Medici Nova Inc.는 진행성 형태의 MS 및 / 또는 신경 병성 통증을 치료하기 위해 경구 이부 딜라 스트 (MN-166)를 단독으로 또는 다른 약물과 조합하여 미국 특허 및 상표 승인을 받았습니다. 몇몇 임상 시험에서 다발성 경화증 환자의 장애 진행 측정에 유리한 효과가 나타났습니다. 약물의 작용 기전에는 류코트리엔 활성, 포스 포 디에스 테라 제 및 산화 질소 합성 효소의 억제가 포함됩니다.
치료 비용 고려 사항
2012 년 글라 티라 머 아세테이트 (Copaxone) 가격은 연간 약 42,300 달러로 2010 년 1 월 이후 39 % 상승했습니다. Novartis의 fingolimod (Gilenya) 가격은 연간 48,000 달러로 더 높습니다. 부분적으로는 정제 형태의 첫 번째 약물이기 때문입니다. 다른 MS 치료는 주사하거나 주입해야 합니다. 2012 년 기준으로 Biogen의 나탈리 주맙 (Tysabri)의 가격은 한 달에 약 $ 3,566 또는 연간 $ 42,788입니다. Biogen Idec에 따르면 Avonex의 가격은 연간 $ 37,544입니다.
결론
FDA는 재발 완화 MS에 대해 8 가지 약물을 승인했습니다. 모두 MRI 뇌 스캔에서 재발 (공격 또는 악화) 수와 새로운 병변 (플라크 또는 흉터) 수를 줄이는 것으로 나타났습니다. 5개의 주사제, 4 개의 베타 인터페론 (Avonex, Betaseron, Extavia 및 Rebif)과 공중 합체 폴리 펩타이드 혼합물 인 글라 티라 머 아세테이트는 일반적으로 MS의 1 차 치료제로 간주됩니다. 대부분의 전문가는 재발 성 다발성 경화증 진단이 확인되는 즉시 이러한 약물 중 하나로 치료를 시작할 것을 권장합니다. 2차 요법에는 나탈리 주맙과 미 톡산 트론 (노반 트론)이 포함됩니다.
다발성 경화증은 지금까지 완치가 없는 진행성 질환입니다. 질병 과정을 관리하기위한 치료법이 있지만 부분적으로 만 효과적입니다. 따라서 일부 환자의 경우 MS는 자신과 의사가 예방하기 위해 하는 모든 조치에도 불구하고 악화됩니다. 다발성 경화증의 가장 흔한 형태인 재발 완화 형 다발성 경화증 환자는 신경 학적 기능이 악화되는 발작을 경험 한 후 부분적 또는 완전 회복을 특징으로 하는 완화 기간을 경험합니다.
약물 치료와 더불어 증상에 맞는 적절한 운동 및 충분한 휴식, 그리고 건강한 영양식은 증상을 완화하고 만족스러운 삶의 질을 향상시킬 수 있습니다. 끝까지 포기하지 말고 삶의 질을 높일 수 있는 방법을 찾아 병증의 진행 없는 시간을 보내시길 바랍니다.
'Health' 카테고리의 다른 글
| (암 정보) 난소암 (0) | 2020.11.12 |
|---|---|
| 혈관을 녹슬게 하는 콜레스테롤 높이는 식품 (0) | 2020.11.11 |
| 양파의 효능은 알겠는데 눈물은 왜 나는 걸까? (0) | 2020.11.10 |
| 다이어트 식품으로 사랑을 받고 있는 과일 파파야의 효능 (0) | 2020.11.09 |
| 신진 대사에 문제가 있다면 이것으로 해결하세요 (0) | 2020.11.08 |
이 글을 공유하기